謝 家暉 准教授らの研究グループは、ゼブラフィッシュを稀少な疾患モデルとして使用し、疾病メカニズムの解明を目指しています。
稀少遺伝病研究のモデルとしてのゼブラフィッシュ
Nager症候群の根本的なメカニズムを研究するためにゼブラフィッシュを使用
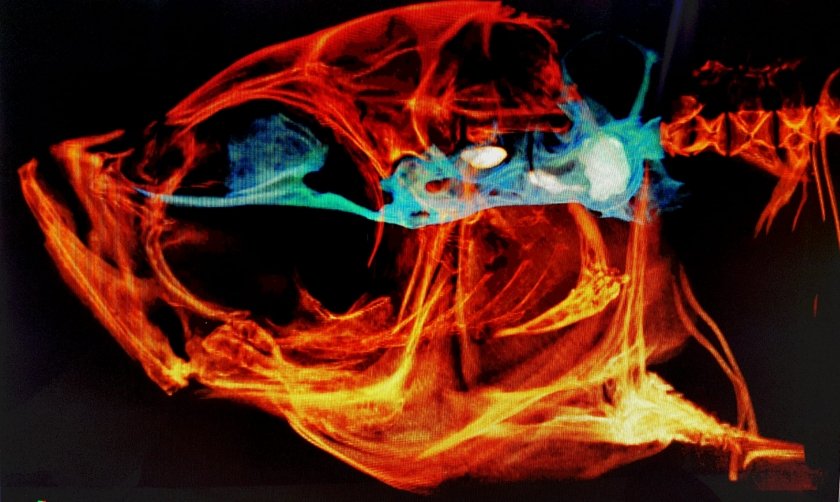
Nager症候群(NS)は、顔や四肢の発達に影響を与える稀少な遺伝病であり、通常、顎、頬、手の骨構造に異常を引き起こします。報告された症例が100例未満であることから、この病気についてはあまり知られていませんが、SF3B4遺伝子の変異が主な原因であることは分かっています。2024年9月15日にオンラインで公開され、 International Journal of Biological Macromolecules の11月号に掲載予定の研究で、九州大学大学院 農学研究院 謝 家暉(TSE KA FAI WILLIAM)准教授を含む九州大学の研究者らはこの極めて稀少な疾患の根本的なメカニズムを探るための画期的な方法を開発しました。
疾患に関連する遺伝子の研究には、動物モデルの使用が最良の方法であることがほとんどであり、ゼブラフィッシュは一般的に使用される動物モデルの1つです。これは、多くの哺乳類に影響を与える遺伝性疾患がゼブラフィッシュにもほぼ同じように影響を与えるため、複雑な疾患のメカニズム解明に役立つからです。
本研究において、研究者らはゼブラフィッシュの顔と頭蓋の発達に関する遺伝的および胚的特徴が哺乳類と類似していることに注目しました。これにより、ゼブラフィッシュがNSのモデルとして使用できることが示唆されました。
そこで、謝 准教授が率いる国際研究チームは、ゼブラフィッシュに変異型sf3b4遺伝子を導入し、ヒトのNSとよく似た状態を再現しました。「私たちは、この稀少な頭蓋顔面疾患の病因を解明するためにゼブラフィッシュモデルを使用しました。疾患の発症と進行に重要な役割を果たす分子を特定し、その重症度を軽減するための潜在的な治療法を見つけることを目指しました」と、九州大学のJSPS外国人招へい研究者であり、本研究の第一著者であるZulvikar Syambani Ulhaq 博士は語ります。
動物モデルが確立された後、研究者らは一連の広範な実験を行い、変異体と非変異体を比較しました。そして、細胞ストレス、骨構造、アポトーシスの慎重な分析の結果、sf3b4欠損ゼブラフィッシュがfgf8遺伝子のレベルを抑制していることを確認しました。これにより、神経堤細胞(NCCs)と呼ばれる細胞の発現パターンに影響を与えます。NCCsは顔面構造の初期発生において重要な役割を果たし、その調節異常がNSの特徴と強く関連している可能性があります。
さらに、研究者らは過剰な酸化ストレスによって引き起こされるアポトーシスがsf3b4欠損ゼブラフィッシュでより顕著に検出され、これがNSの病因に寄与している可能性があることを発見しました。さらに重要なことに、変異ゼブラフィッシュにヒト由来のFGF8を注射すると、NSの顔面特徴が著しく改善されました。このことは、病気の潜在的な治療戦略を示唆しています。
謝 准教授は、あまり解明されていない稀少疾患について基礎研究を行うことの重要性を以下のように強調しています。「がんや糖尿病とは異なり、NSのような稀少疾患は製薬会社の優先研究目標ではなく、それらに苦しむ少数の患者は常に見過ごされています。我々の研究はこの疾患メカニズムを解明し、患者に希望をもたらすことができます。」
謝 准教授の研究グループは、臨床医、患者、家族、基礎研究者など、さまざまな関係者からの連携や寄付を歓迎しています。「私たちの理念に賛同し、稀少疾患の基礎研究に貢献したいとお考えの方は、ぜひご連絡ください」と謝 准教授は語ります。
###
この研究に関する詳細はFgf8 contributes to the pathogenesis of Nager syndrome", Zulvikar Syambani Ulhaq, May-Su You, Taijiro Yabe, Shinji Takada, Jen-Kun Chen, Yukiko Ogino, Yun-Jin Jiang, and William Ka Fai Tse, International Journal of Biological Macromolecules,https://doi.org/10.1016/j.ijbiomac.2024.135692
Research-related inquiries












 お問い合わせ
お問い合わせ
 アクセスマップ
アクセスマップ

