角田教授、寺本助教らの研究グループ(応用生命化学分野・生物物理化学研究室)が、共同研究で病原性真菌の細胞壁形成に重要な酵素GfsAの立体構造を解明しました。
~新規の作用機序を有する抗真菌薬・農薬開発に期待~
ポイント
- ガラクトフラノース転移酵素GfsAの結晶構造を世界で初めて解明
- GfsAのもつ5位水酸基への特異的ガラクトフラノース転移メカニズムを解明
- 新規の抗真菌薬・農薬の開発に向けた重要な基礎的知見を提供
概要
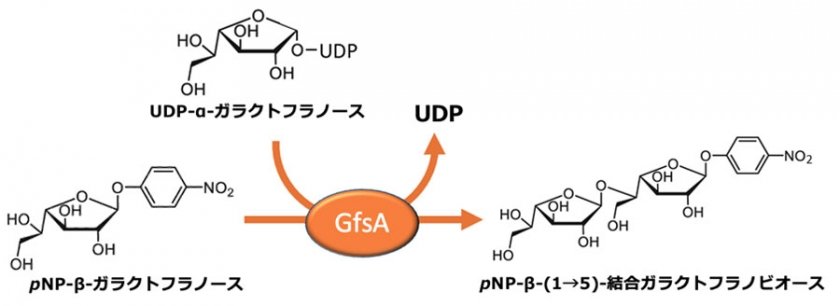
アスペルギルス・フミガーツスは肺アスペルギルス症の主要な原因菌であり、特に免疫力が低下した方に致命的な感染症を引き起こす場合があります。しかし、肺アスペルギルス症に対する効果的な治療薬は限られており、既存の抗真菌薬に対する耐性菌の出現が世界的な問題となっています。真菌の細胞壁は細胞を保護するために必要不可欠な構造体で、主に5種類の糖鎖が三次元的に複雑に絡み合って形成されています。GfsAは細胞壁を構成する糖鎖の1つであるガラクトフラノース鎖の合成を担う中心的な酵素です。GfsAは2013年に岡教授らによって発見された糖転移酵素であり、UDP-α-ガラクトフラノースを糖供与体として、β-ガラクトフラノースの5位水酸基に β-ガラクトフラノースを連続的に転移し、最大で鎖長7の β-(1→5)-結合ガラクトフラノース鎖を合成します(図1)。GfsAは、この反応を担う酵素であり、国際生化学・分子生物学連合によって ECナンバー2.4.1.398が付与されています。gfsA遺伝子を破壊した菌株では、正常な細胞壁を作ることができず、菌糸の伸長が抑制されることが確認されています。しかし、GfsAの結晶構造やガラクトフラノース転移反応メカニズムはこれまで不明であり、抗真菌薬開発の障害となっていました。
崇城大学生物生命学部生物生命学科 岡拓二 教授、平大輔 教授、門岡千尋 助教、九州大学大学院農学研究院 角田佳充 教授、寺本岳大 助教らは、真菌の細胞壁に含まれる珍しい糖鎖であるガラクトフラノース鎖の合成酵素であるGfsAの立体構造を明らかにし、5位水酸基への特異的な糖転移反応メカニズムを解明しました。
本研究結果は 2024年10月25日に「PNAS Nexus」に掲載されました。
論文情報
論文タイトル:Substrate binding and catalytic mechanism of UDP-α-D-galactofuranose: β-galactofuranoside β-(1→5)-galactofuranosyltransferase GfsA
著者名:Takuji Oka, Ayana Okuno, Daisuke Hira, Takamasa Teramoto, Yuria Chihara, Rio Hirata, Chihiro Kadooka, Yoshimitsu Kakuta
雑誌名:PNAS Nexus
DOI: 10.1093/pnasnexus/pgae482
- 本件の詳細についてはこちら
詳細およびお問い合わせ先












 お問い合わせ
お問い合わせ
 アクセスマップ
アクセスマップ

